Accueil > Traitements Recherche > Essais cliniques > essais de supériorité et de non infériorité
Protocoles 67-68 - design des essais
 essais de supériorité et de non infériorité
essais de supériorité et de non infériorité
samedi 1er octobre 2011
Dans le dernier numéro de Protocoles, nous avions abordé le premier sujet traité au cours du nouvel atelier sur le design des essais thérapeutiques mis en place cette année à la conférence sur les rétrovirus et les infections opportunistes (CROI) ; il s’agissait du principe d’incertitude dans les essais thérapeutiques. Cette fois, nous revenons sur la seconde intervention, par Deborah Donnell, statisticienne à l’institut des vaccins et des maladies infectieuses du centre de recherche sur le cancer Fred Hutchinson à l’Université de Washington à Seattle aux Etats-Unis. Elle présentait les différences entre les essais dits de supériorité et de non infériorité.
Ces essais s’inscrivent dans la suite d’essais (phase I et II) qui ont montré une sécurité d’emploi et un potentiel bénéfice clinique pour le nouveau traitement envisagé. Deborah Donnell rappelle d’emblée que, quel que soit le type d’essai (supériorité ou non infériorité), le but d’un essai thérapeutique est d’apporter une réponse fiable à une question importante. La question diffère selon le type d’essai.
Dans un essai de supériorité, il n’y a pas de médicament efficace et la question posée est de savoir si le nouveau traitement expérimental envisagé est meilleur qu’un placebo [1].
Il s’agit donc de déterminer si le nouveau traitement évalué apporte un bénéfice clinique significatif, pouvant changer la pratique.
Dans le cadre d’un essai de non infériorité, il y a déjà un traitement standard efficace ; la question est donc : le nouveau traitement expérimental envisagé est-il semblable au traitement standard ? La comparaison n’est donc pas avec un placebo. En effet, cela ne serait pas éthique dans la mesure où il existe déjà un traitement avec une efficacité substantielle démontrée. Les motivations sous-jacentes à ce type d’essai reposent sur des arguments laissant supposer que le nouveau traitement pourrait apporter un bénéfice par rapport au traitement existant en termes d’effets secondaires ou de facilité de prise (une fois par jour au lieu de deux, par exemple). Il peut aussi s’agir de coût de traitement. L’essai revient concrètement à déterminer si le nouveau traitement est aussi bon ou moins bon que le standard en se fixant une limite pour statuer jusqu’à quel point on accepte qu’il soit moins bon.
Prenons un exemple concret pour mieux comprendre cette notion de non infériorité. Dans les essais cliniques de nouveaux traitements antirétroviraux, l’élément que l’on cherche à déterminer est souvent le pourcentage de personnes ayant une charge virale contrôlée [2] après un certain temps pour un traitement donné. On va ainsi comparer le pourcentage pour le groupe recevant le traitement expérimental et celui pour le groupe recevant le traitement standard. On peut alors calculer la différence entre ces deux pourcentages. Remarquons que cette différence peut être négative – il peut y avoir moins de contrôle viral dans le groupe expérimental – et c’est dans cet esprit qu’est conduit l’essai de non infériorité. Les investigateurs cherchent à vérifier que le pourcentage obtenu avec le traitement expérimental se rapproche de celui du traitement standard et qu’il ne lui est pas inférieur au-delà d’une certaine marge.
La réalité n’est pas aussi simple, car on ne dispose pas de la vraie valeur de ces différences (ou de tout autre paramètre étudié), seulement d’estimation sur la population des personnes recrutées dans l’essai. Pour pouvoir conclure, les investigateurs font appel à la méthodologie des statisticiens. Si vous souhaitez en savoir plus, nous vous proposons de vous référer à l’encadré suivant.
les questions et outils statistiques
Questions statistiques
Ce qui précède peut être résumé par les formulations statistiques suivantes – elles sont parfois déroutantes, mais procèdent d’une méthodologie stricte. Pour un essai de supériorité, la méthode statistique cherche à savoir dans quelle mesure on peut exclure la possibilité que le traitement expérimental soit semblable à l’effet du placebo. C’est la fameuse hypothèse nulle (pas de différence). Dans le langage statistique approprié, pour un essai de supériorité, la question devient : pouvons-nous rejeter l’hypothèse nulle ? Pour un essai de non infériorité, la question se traduit en termes statistiques par : pouvons-nous exclure le fait que le traitement expérimental soit moins bon que le standard avec une marge donnée ? Pour répondre à ces questions, les statisticiens utilisent des outils spécifiques, dont l’intervalle de confiance.
Définition de l’intervalle de confiance
Au cours d’un essai clinique, on peut chercher à déterminer, pour reprendre l’exemple ci-contre, le pourcentage de personnes en fin d’essai contrôlant leur charge virale dans deux groupes distincts. La différence entre les deux constitue alors le paramètre à déterminer. Il peut aussi s’agir du nombre de CD4 gagnés au cours de l’essai (voir des exemples concrets dans l’article de ce numéro sur la rilpivirine, par exemple). Dans tous les cas, la valeur trouvée est dite expérimentale, car elle repose sur un échantillon de personnes et ne constitue pas la vraie valeur du paramètre correspondant. Si l’on avait effectué un autre essai avec des personnes différentes, d’autres valeurs auraient été trouvées.
Pour un essai donné, on détermine l’intervalle de valeurs du paramètre étudié qui a 95% de chance de contenir la vraie valeur de ce paramètre pour les conditions évaluées. Cet intervalle est appelé l’intervalle de confiance à 95%. C’est un moyen pour les investigateurs cliniques d’estimer l’incertitude qui existe sur la valeur du paramètre trouvée. Concrètement, toute valeur à l’intérieur de cet intervalle n’est pas significativement différente, en terme statistique, de la valeur observée, contrairement à celles en dehors.Utilisation de l’intervalle de confiance
Munis de l’intervalle de confiance obtenu pour la valeur étudiée au cours de l’essai, nous allons voir comment les investigateurs vont pouvoir conclure statistiquement entre des différences éventuelles entre les groupes comparés. Rappelons que la méthodologie statistique et donc le type d’essai envisagé sont choisis avant la réalisation de l’essai.
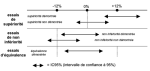
Pour un essai clinique de supériorité, la valeur zéro revêt une importance particulière, et plus encore les écarts par rapport à cette valeur. On va donc regarder si l’intervalle de confiance à 95% pour l’essai contient la valeur zéro. Si ce n’est pas le cas, il y a bien supériorité du traitement expérimental par rapport au placebo (voir haut de la figure). A priori et sauf extraordinaire, suite aux essais préalables suggérant une supériorité du traitement expérimental, on ne s’attend pas à ce que l’intervalle soit en dessous de 0% …
Pour un essai clinique de non infériorité, c’est la marge choisie inférieure à zéro qui est l’élément pivot. Pour illustrer cela (milieu de figure), le choix s’est porté sur une valeur de moins 12% et ce choix initial est un peu arbitraire. En fait, c’est l’expérience antérieure qui permet de choisir au mieux cette valeur (voir la présentation en anglais à la CROI de Deborah Donnell, http://retroconference.org/2011/data/files/webcast_2011.htm,
pour une illustration de cette difficulté). La non infériorité sera démontrée seulement si l’intervalle de confiance à 95% est au-dessus de la valeur de la marge (voir milieu de figure).Il existe aussi des essais moins courants appelés d’équivalence. Dans ce cas, pour conclure à l’équivalence, l’intervalle de confiance devra être compris entre deux bornes centrées autour de zéro, toujours fixées au départ (par exemple, ±12%, voir le bas de la figure).
Utilisation de l’intervalle de confiance pour conclure sur la différence observée entre le traitement expérimental et le comparateur. Pour un essai de supériorité, la question est de savoir si l’intervalle de confiance à 95% contient la valeur 0, pour un essai de non infériorité avec une marge fixée à -12%, la question est de savoir si l’intervalle est au-dessus de cette valeur et pour un essai d’équivalence, si l’intervalle est compris entre -12 et +12%. Pour un essai d’équivalence, si l’intervalle est entièrement au-delà de l’une ou l’autre de ces valeurs, cela peut être interprété comme une différence d’effet au niveau clinique. Il en est de même pour un essai de non infériorité quand l’intervalle est entièrement en dessous de -12%. Par contre, si l’intervalle est au-dessus de 0% à l’issue d’un essai de non infériorité, il est possible de déclarer la supériorité du traitement expérimental.
[1] substance inerte, sans activité pharmacologique, ayant la même apparence que le produit auquel on souhaite le comparer
[2] c’est-à-dire indétectable avec les techniques usuelles, par exemple une charge inférieure à 50 copies par millilitre
 Act Up-Paris
Act Up-Paris